Tercer Milenio

En colaboración con ITA
Mendeleiev une química y periodicidad
La primera tabla periódica fue creada en 1869 por Mendeleiev al ordenar los elementos atendiendo a la periodicidad que mostraban sus propiedades químicas. Con motivo de su siglo y medio de vida, Naciones Unidas ha declarado 2019 como el Año Internacional de la Tabla Periódica. Nosotros rescatamos este artículo publicado el 27 de enero de 2004 en Tercer Milenio, en la sección 'La primera... y la última'.
El 17 de febrero de 1869, el químico ruso Dimitri Ivanovich Mendeleiev alcanzó por fin la solución a un problema al que llevaba dándole vueltas desde que había comenzado a preparar su libro de texto 'Principios de Química' y se había planteado cómo estructurar los contenidos: la ordenación sistemática de los elementos. Para resolverlo escribió el nombre de los 65 elementos conocidos por aquel entonces en tarjetas individuales junto a sus propiedades químicas más importantes -entre ellas el peso atómico y la valencia de enlace- y se dedicó a probar distintas distribuciones. La primera tabla periódica nació cuando una de aquellas combinaciones le satisfizo y la copió en un papel. Dos años más tarde, en 1871, y tras realizar algunos ajustes, publicaba la versión definitiva de la primera tabla, con los elementos agrupados en columnas verticales en lugar de horizontales como en su predecesora. Una distribución que, en esencia, se ha mantenido desde entonces.
El gran logro de Mendeleiev fue percatarse de que la periodicidad era algo inherente a la naturaleza química. Una idea que plasmó tanto en la teoría, con su ley periódica: "Las propiedades de los elementos químicos no son arbitrarias sino que varían con sus pesos atómicos de forma sistemática"; como en la práctica, al disponer los elementos en una tabla en la que cada uno estaba "predestinado" a una casilla determinada en función de sus propiedades.
Expresado de un modo intuitivo, no había que construir una tabla en función de los elementos conocidos, sino que estos se debían encajar en una tabla "natural, perfecta". Tan seguro estaba de ello que en su tabla dejó huecos -en los sitios donde ninguno de los elementos conocidos verificaba la periodicidad esperada-, destinados a elementos aún por descubrir, de los que, además, predijo con gran precisión las propiedades químicas que deberían presentar a partir de la posición que ocupaban en la tabla periódica .
Fechas
1869 Mendeleiev concibe y publica la primera tabla periódica junto a su ley periódica.1870 Meyer, que había desarrollado también un sistema de clasificación de los elementos prácticamente análogo, publica sus resultados. Demasiado tarde.1871 Se publica la versión más conocida de la tabla periódica de Mendeleiev.1875 Boisbaudran descubre el galio. Sus propiedades son las predichas por Mendeleiev. Es el impulso definitivo para la tabla.1923 Deming incluye en su libro de texto la versión ampliada, con el formato moderno, de la tabla periódica .1944 Seaborg formula la hipótesis actínida, con la que las series de los lantánidos y actínidos encuentran su ubicación definitiva en la tabla periódica .Julio de 2003 Se presenta la Tabla cosmoquímica de los elementos del Sistema Solar.
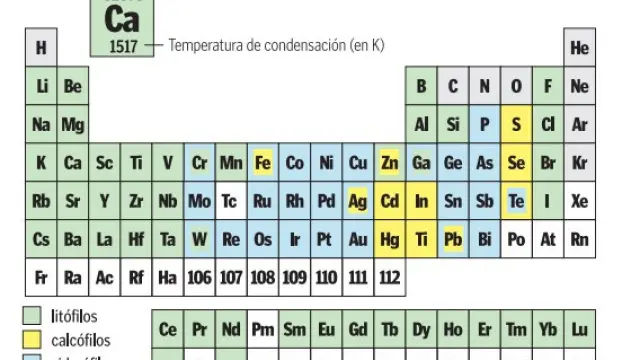
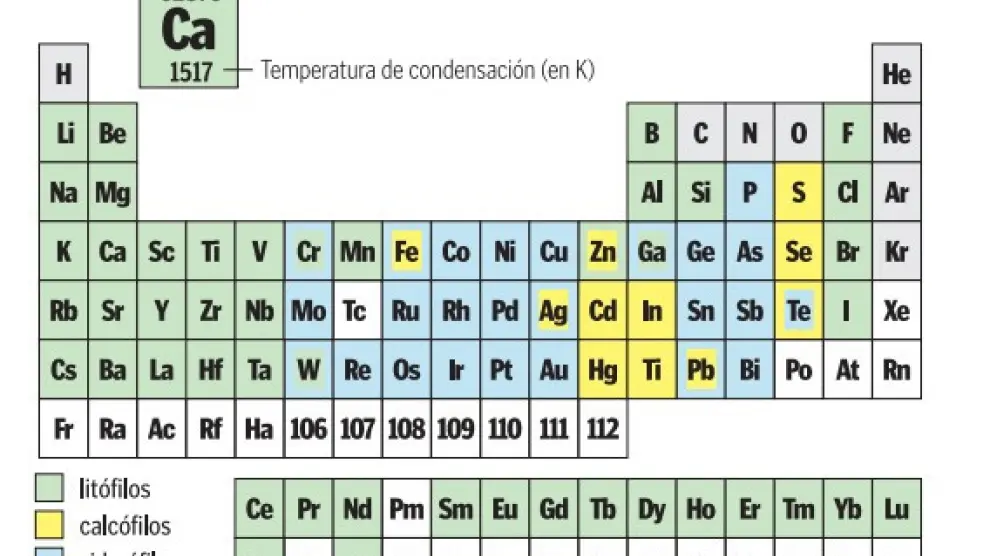
Bautizada con el pomposo nombre de 'Tabla periódica cosmoquímica de los elementos del Sistema Solar', la nueva tabla nace con la pretensión de convertirse en herramienta de trabajo indispensable para astrónomos, cosmoquímicos y, en general, aquellos investigadores que se dediquen al estudio de planetas, satélites, estrellas y demás cuerpos espaciales. Por este motivo, aunque la tabla mantiene la estructura clásica con los elementos distribuidos en 18 grupos, las propiedades que refleja son distintas a las habituales. Así, en el lugar que en cada casilla de modelos anteriores ocupaban el número atómico, el peso atómico o los puntos de fusión y ebullición, ahora se encuentran datos más útiles desde una perspectiva espacial como la abundancia de dicho elemento en el Sistema Solar (en millones de átomos) y su temperatura de condensación en grados Kelvin (K).
No obstante, la novedad más destacada o cuando menos la más llamativa es el código de colores que presenta la tabla y que indica el estado habitual en que se encuentran los distintos elementos, o, dicho de otro modo, la forma o fase -que no estado- en que suele aparecer cada elemento en la Naturaleza debido a procesos geoquímicos. Un criterio que divide a los elementos en cuatro categorías: siderófilos, litófilos, calcófilos y atmófilos; y una más por omisión (reflejada con la ausencia de color en la 'última'): los elementos radiactivos, no incluidos debido a que presentan un periodo de vida demasiado corto en términos geológicos como para tener una geoquímica independiente, esto es, formar sus propios minerales.
Contrastes
La primera tabla, dispuesta verticalmente, incluía sólo 65 elementos y algunos huecos. La última incluye los 109 elementos en 18 grupos y está dispuesta horizontalmente.Los únicos datos incorporados en la primera son el símbolo químico y el peso atómico de cada elemento. En la última, además del símbolo se especifica su abundancia en el Sistema Solar, su temperatura de condensación y la fase en la que aparece de forma natural.Entre la primera y la última ha habido más de 700 versiones.En la última, la disposición de los elementos está basada en su número atómico y la distribución de los electrones. En la primera, en el peso atómico y la valencia química.En la primera solo había una inversión (teluro-iodo) en el orden creciente de los pesos atómicos (aunque el peso atómico del teluro es mayor que el del iodo, Mendeleiev lo situó antes porque sus propiedades químicas casan más con las de los elementos del grupo anterior). En la última hay cuatro pares de elementos invertidos.Este artículo fue publicado el 27 de enero de 2004 en Tercer Milenio